广泛的腹腔播散和转移是晚期卵巢癌最显著的特征之一。目前晚期卵巢癌的标准治疗方法是细胞减灭术联合腹腔灌注热化疗。然而,想在手术过程中完全切除所有的微小肿瘤极其困难,因此大多数患者都无法实现最佳的肿瘤减灭术。虽然腹腔灌注热化疗可以改善患者预后,但这种治疗是非靶向的,可能会损害健康器官并引起并发症。因此急需可实现精确检测、完全消除且没有副作用的治疗播散性微肿瘤的新策略。
近日,上海交通大学生物医学工程学院叶坚教授的团队联合上海交通大学医学院附属仁济医院狄文教授的团队,在术中拉曼检测引导的热化疗协同治疗晚期播散性卵巢癌方面取得突破性进展,研究成果以“Intraoperative Raman-Guided Chemo-Photothermal Synergistic Therapy of Advanced Disseminated Ovarian Cancers”为题发表在微纳米材料领域著名期刊《Small》(IF = 9.59)上。
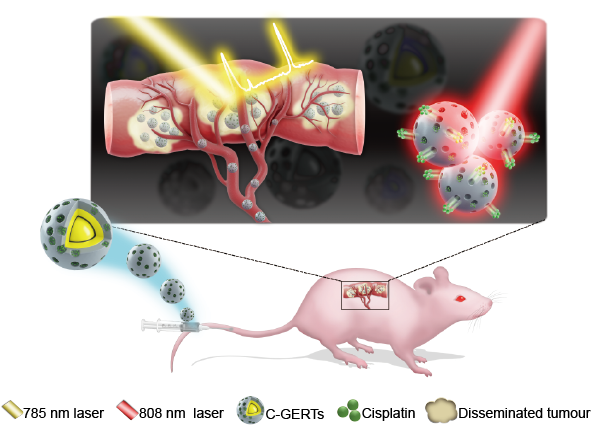
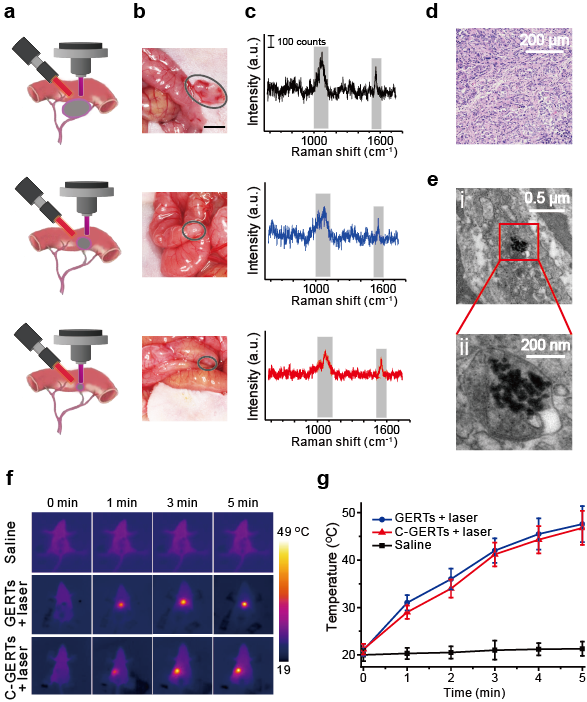
基于表面增强拉曼散射技术的术中微小肿瘤检测是一种很有前景的检测方法,具有非常高的灵敏度和特异性。研究团队设计制备了载顺铂的缝隙增强拉曼探针(C-GERTs), 专门用于术中检测和消除不可切除的播散性晚期卵巢癌。凭借特异且超强的拉曼信号,良好的生物相容性,良好的等离激元光热转换效率和药物负载和控释能力,C-GERTs可以检测到最小直径仅为1 mm的微肿瘤,并可通过探针实现原位特异性热化疗协同消除微肿瘤,从而减少副作用,显著延长小鼠的生存期。结果表明,基于C-GERTs的热化疗协同疗法可有效地控制小鼠肿瘤的扩散,有潜力作为一种安全有效的方法治疗晚期卵巢癌,以改善患者的生存期和生活质量。
上海交通大学生物医学工程学院的博士生张雨晴和仁济医院的博士后刘志洋是该论文的共同第一作者,叶坚教授和狄文教授为共同通讯作者。该研究工作得到了国家重点研发计划、上海市卫生和计划生育委员会基金、上海交通大学医工交叉研究基金的支持。
此研究成果是叶坚课题组在缝隙增强拉曼探针的生物医学应用领域的又一创新性突破。自2015年以来课题组已陆续在缝隙增强拉曼探针的合成调控(Chemical Communications,2015)、增强机理研究(Nano Letters,2015;ACS Nano,2018)、分子层光学折射指数测量(Nanoscale, 2017)、超光稳定探针的合成和快速成像(ACS Applied Materials& Interfaces, 2017; RSC Advances,2018)、术中前哨淋巴结显影(Biomaterials,2018)等方面取得重大进展。
论文链接:https://www.onlinelibrary.wiley.com/doi/abs/10.1002/smll.201801022
供稿:张雨晴
