关节软骨损伤是临床上最为常见的关节退行性疾病,尤其在中老年人群中发病率极高(65岁以上发病率大于69%),累及人群巨大,严重影响中老年人的生活质量。针对局限性软骨缺损的中度退变患者,临床上主要采用微骨折术或自体软骨移植术进行治疗,但是该类手术仅限于小范围的软骨缺损修复,且供体来源十分有限,特别是移植软骨与周围正常软骨整合欠佳(马塞克现象)。
最新研究结果表明,组织工程与再生医学技术为解决上述难题提供了全新的治疗策略。软骨组织工程是通过结合自体软骨细胞和三维支架材料(如水凝胶材料)进行关节软骨缺损修复的先进技术。随着微创手术的普遍应用,基于水凝胶材料的软骨组织工程技术能否与关节镜手术结合使用一直是临床医生关注的焦点问题。由于关节镜手术需要在一定的水压(~10 kPa)下实施操作,这对于当前的水凝胶材料无疑提出了巨大的挑战:水凝胶材料需要通过关节镜装置准确注射至缺损部位并在水下快速固化,固化后需要与周围组织牢固粘合且在水压环境维持机械稳定性。迄今为止,没有任何一项水凝胶技术能够突破这一技术壁垒。
近期,上海交通大学生物医学工程学院林秋宁研究员、上海交通大学附属第九人民医院周广东研究员联合设计了一种超快、高强、强粘的杂化光交联水凝胶技术(如图一)。该类水凝胶技术能够满足关节镜手术实施软骨缺损修复的苛刻要求,即在水压环境下实现光固化操作,并通过负载自体软骨细胞的水凝胶支架材料,成功实现了大动物(猪)负重区关节软骨缺损修复。
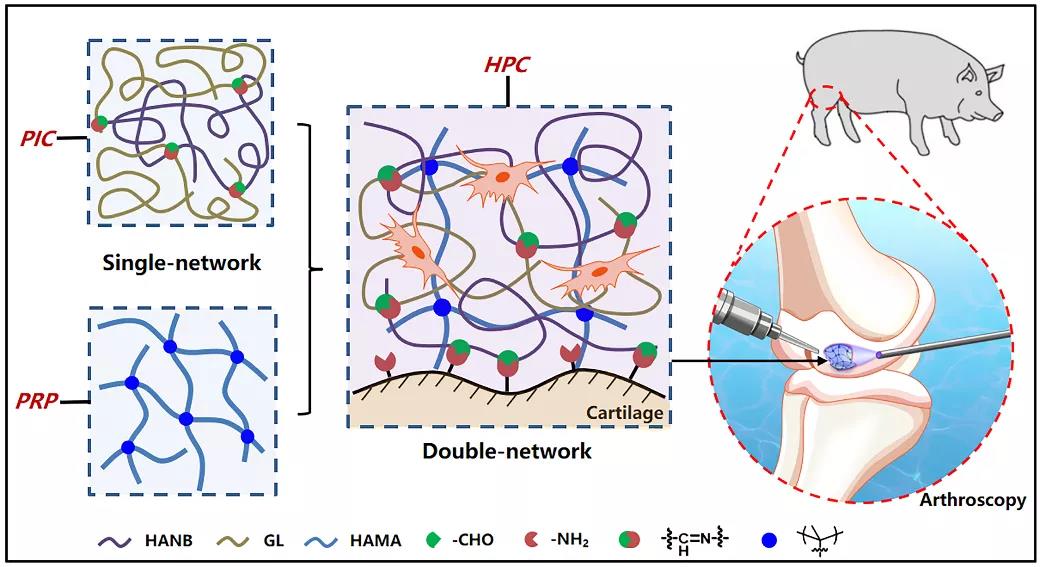
图1 杂化光交联水凝胶技术的构建示意图
该研究团队在“光偶合交联”技术构建水凝胶材料多年的经验与基础上,通过结合光致亚胺交联策略和传统的光引发自由基聚合交联策略,构建了秒级固化、高强、高粘的双网络光交联水凝胶:1)透明质酸高分子上双建官能团的快速聚合交联(第一重网络);2)另一透明质酸高分子上的邻硝基苄醇在光照下生成的醛基与明胶上的氨基发生亚胺交联(第二重网络)。同时,光致亚胺交联赋予的组织粘附力(Adv. Mater. 2016, 28, 2724)能够有效实现与周围组织的化学键键合固定。
进一步,系统地研究并表征了杂化光交联水凝胶的理化特性。实验结果表明:该类凝胶技术具有超快的交联速度(约1 s;如视频一)、较高的力学性能(约2 MPa)、以及较高的组织粘附能力(凝胶-软骨界面强度:纵向拉伸力16.4±1.2 kPa;横向剪切力29.0±3.2 kPa;如图二)。同时,该类凝胶技术具有优异的生物相容性和生物降解性,以及较低的免疫炎症反应,结合软骨细胞的水凝胶材料,能够在裸鼠皮下再生成熟的组织工程软骨。
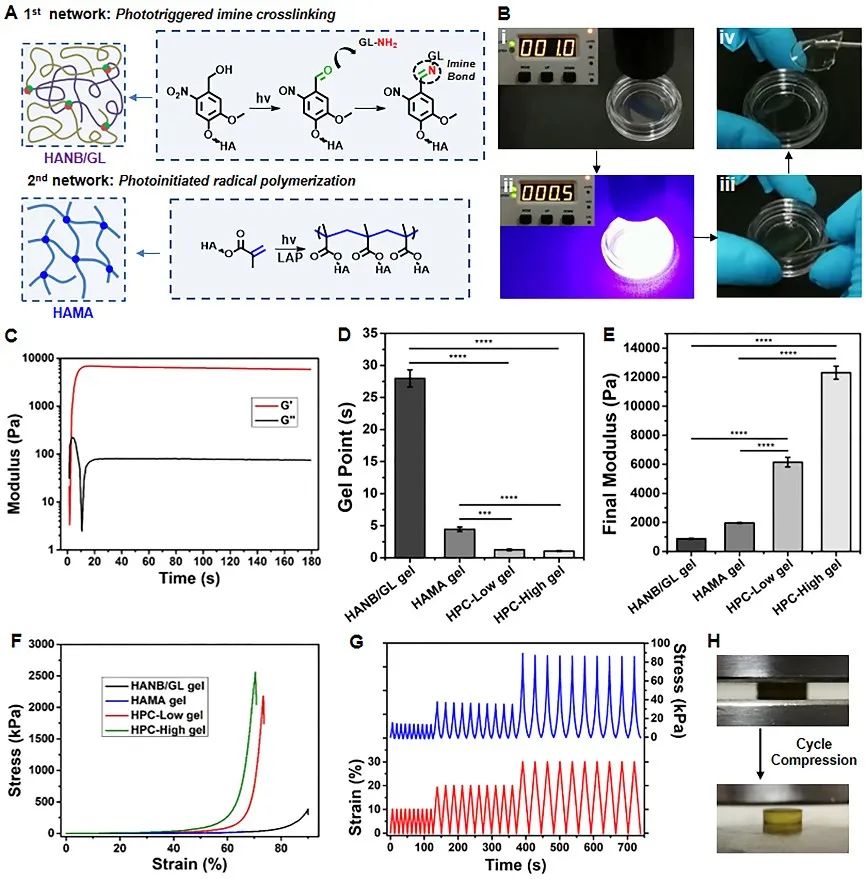
图2 杂化光交联水凝胶的理化特性表征
接着,重点探讨了杂化光交联凝胶技术结合关节镜手术实施水下原位软骨缺损修复的可行性。实验中,水凝胶前体溶液可以结合为该技术量身定制的关节镜辅助装置,方便地注射至水下的软骨缺损部位,并随即打开395 nm光源照射,实现快速固化并与周围软骨组织一体化整合(如视频二)。同时,固化后的凝胶-软骨复合物能够承受47.8±6.5 kPa强度的水压,这远远超出了临床上关节镜手术所需的水压(~ 10 kPa)。
最后,应用杂化光交联水凝胶包裹自体软骨细胞实施了在体关节镜手术,并成功修复了猪关节负重区的软骨缺损。与体外模拟实验结果一致,该类水凝胶技术可以在连续液体(生理盐水)灌溉压力(~ 10 kPa)下,精准修补软骨缺损(如视频三)。修复6月后,关节软骨缺损基本被新生的透明软骨组织覆盖,呈现出软骨特异性染色和典型的软骨陷窝结构,并且与周围正常软骨组织实现一体化整合(如图三)。综上所述,该类凝胶技术集可控快速交联、优异机械性能以及可组织粘附的特性,满足关节镜手术水压环境下的应用要求,有望拓展成为微创手术盛行趋势下软骨缺损治疗的新策略。
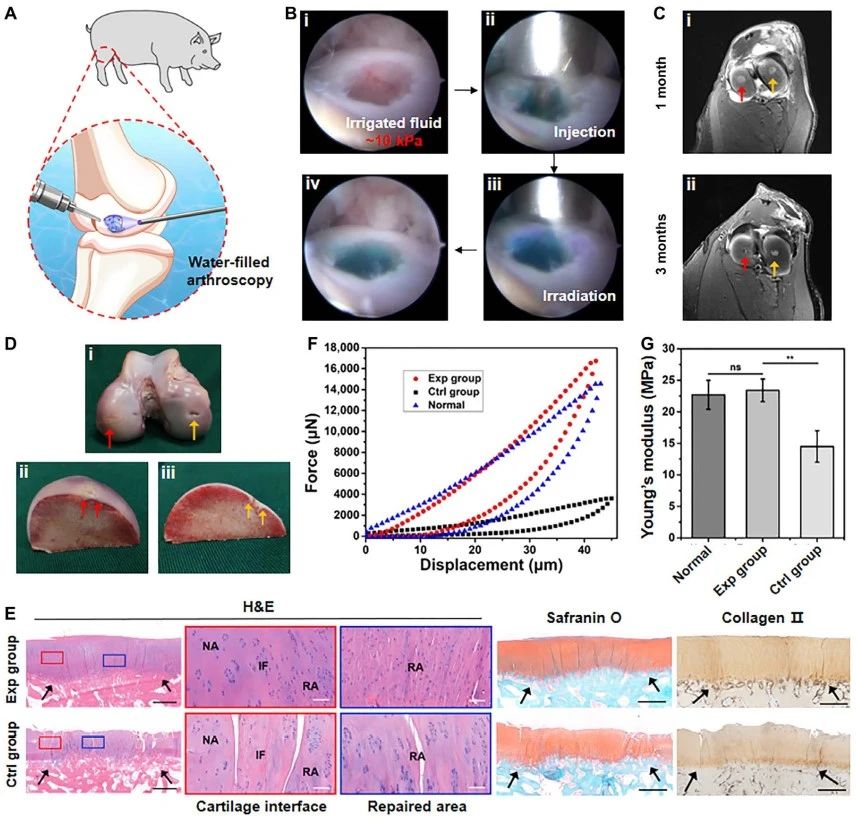
图3 杂化光交联水凝胶技术用于关节镜手术下的在体软骨缺损修复
相关论文“Ultrafast, tough, and adhesive hydrogel based on hybrid photocrosslinking for articular cartilage repair in water-filled arthroscopy”已被《Science Advances》在线刊登。华宇杰博士、夏会堂博士及贾立涛为共同一作,周广东研究员、林秋宁研究员为通讯作者。该工作得到了上海交通大学朱麟勇教授的悉心指导,上海交通大学附属第六人民医院赵金忠主任团队的大力支持,以及国家重大研发计划(2019YFA0110500 、2017YFC1103900)等项目支持。
