RNA作为遗传物质的传递者,参与细胞生命的整个过程,与多种重大疾病的发生和发展密切相关。RNA示踪是RNA研究的前提,在RNA研究领域,开发能够在活细胞层面使用的RNA成像技术一直是所有研究人员共同追求的目标。其中,荧光成像技术由于其非物理接触、实时原位的技术优势,成为当前RNA研究最重要的手段。尽管针对蛋白的荧光成像技术已经相当成熟,并于2008年获得诺贝尔化学奖,但是这些技术却无法直接复刻用于RNA成像。究其原因,RNA本身结构较小,不稳定,而且表达丰度低,对成像所需时间、信噪比以及探针大小都提出了极为苛刻的要求。因此,目前能够在活细胞层面对RNA进行成像的技术屈指可数,并造成RNA相互作用、功能的研究举步维艰。

RNA拥有复杂的空间分布和动态轨迹,与多种生物分子存在相互作用,并通过这些相互作用发挥其功能。研究RNA功能通常需要将这些动态变化以及相互作用通过荧光信号进行动态显示,因此多目标分子同步的荧光成像,即多色成像,对于RNA研究尤为重要。从荧光染料设计的角度看,多色成像要求各染料分子的发射光谱完全分离,避免因光谱重叠带来信号干扰。然而,当前用于RNA成像的荧光染料大多处于蓝绿光区域,发射光谱严重重叠,无法满足多色成像的需求。解决问题的关键在于染料光谱设计:如何在有限的可见光光谱范围内布置多个发射光谱不重叠的荧光染料。考虑现有染料蓝绿光的发射光谱,设计染料的激发谱应当与现有染料重叠,而发射谱应尽可能红移以避免与现有染料谱图重叠。简而言之,需要增加染料的激发光谱和发射光谱间距(斯托克斯位移)。
从谱图原理分析,染料分子在基态吸收光子后跃迁到激发态(S1),经过一系列的能量耗散后,再从一个低能激发态(Stran)以荧光发射的方式回到基态。增加染料的激发光谱和发射光谱间距,实质上就是增加S1和Stran之间的能量差,也就是在发射荧光之前,如何通过非辐射的方式尽可能多地消耗激发态能量。通过研究团队发现,增加染料分子结构的转动能力,能够增加分子在激发态的构象数量,进而增加分子激发态的非辐射能量耗散。基于这一发现,团队在原创的分子转子型染料的骨架结构上,引入更多的转动位点,从而使得染料的发射光谱大幅度红移,斯托克斯位移显著增加,最高可达108 nm,高出传统荧光染料至少4倍。
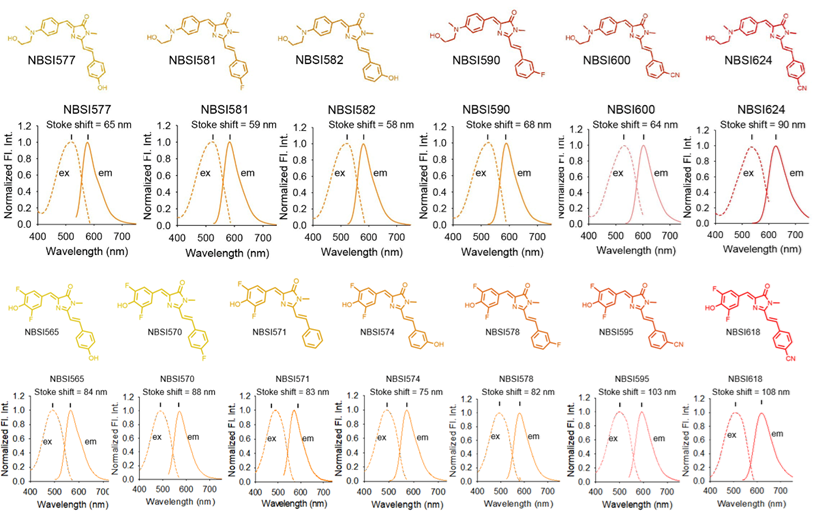
图1 具有大斯托克斯位移荧光染料的化学结构及其激发发射光谱
基于该类染料与现有染料发射光谱的显著区别,因此能够与现有荧光技术联合使用,用于多个RNA分子的实时荧光追踪。值得指出的是,该类染料沿袭了分子转子型结构设计带来的优势,具有高信噪比、快速成像特点;同时,该类染料与前期研发的分子转子型荧光染料在激发光谱上重叠,但在发射光谱上显著区分,二者发射光谱间距高达100 nm。研究团队基于这两类染料的联合使用,成功在活细胞中实现了多个RNA分子的同时监测。基于RNA的碱基互补配对,该技术能够进一步实现对基因位点的多色成像研究。不仅如此,通过荧光强度与基因拷贝数的正比关系,团队建立了活细胞中基因端粒拷贝数的定量方法,推动活细胞层面染色体功能和空间结构的研究。
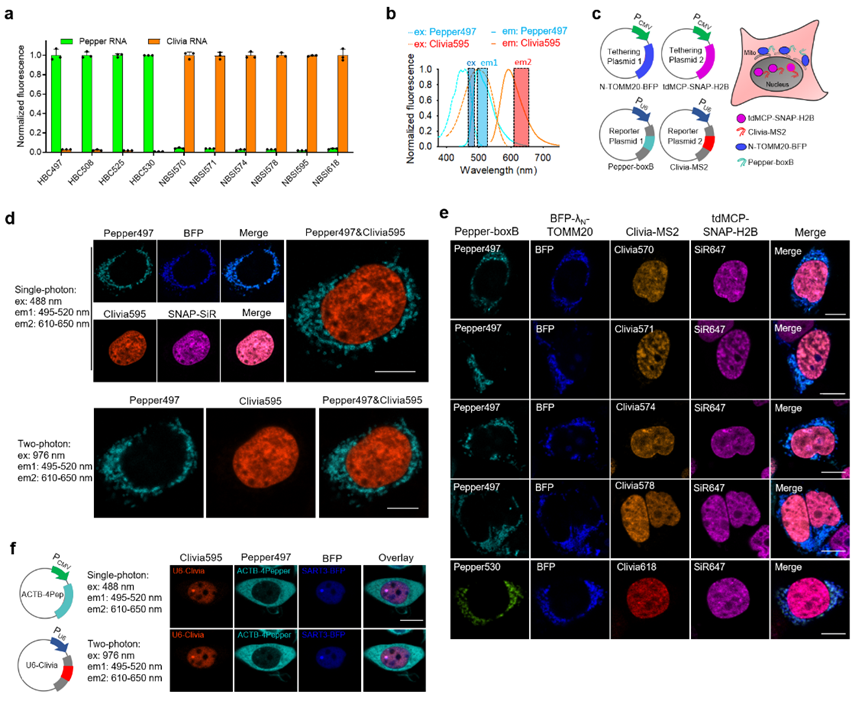
图2 两个荧光RNA联合用于活细胞RNA的多色成像
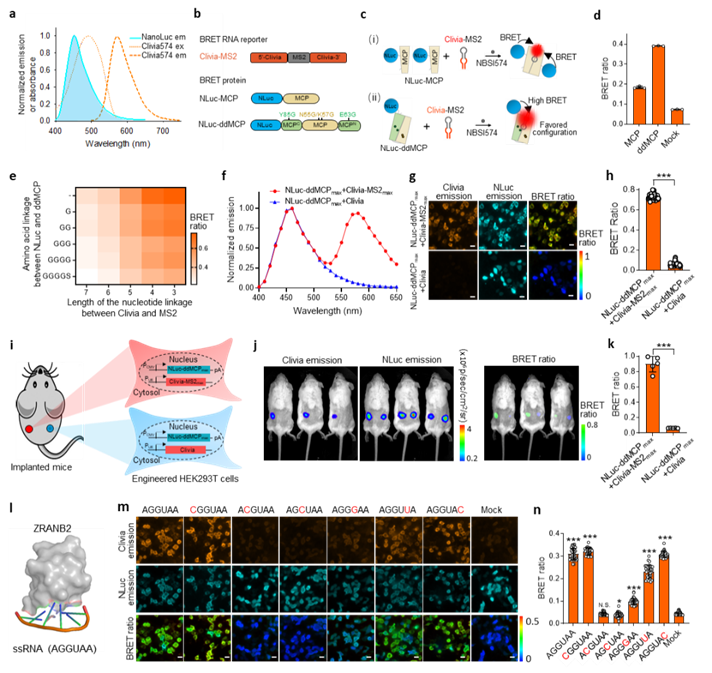
图3构建生物发光能量转移体系用于活细胞/活体中蛋白质和RNA相互作用的动态
关于团队
朱麟勇教授团队一直聚焦于生物医用材料的研发,利用“光” 的可视与可控的独特优势,在 “光化学方法构建生物医用材料”方向的研究形成了鲜明特色。在荧光探针方向,开发了一系列分子转子型荧光染料,光谱范围覆盖整个可见光谱,并延伸至近红外,为蛋白、RNA在活细胞乃至活体的荧光成像提供了不可或缺的可视化工具(Nature Biotechnology, 2019, 37, 1287; Cell Discovery, 2023, 9, 56;Nature Chemical Biology, 2021, 17, 1289)。在“光化学方法构建生物医用材料”方向,提出并发展“光偶联反应”原位凝胶技术,实施高机械强度与强组织粘附的水凝胶生物材料的超快构建,并由此推动医用光敏生物胶产品的临床转化(Nature Materials, 2023, https://doi.org/10.1038/s41563-023-01648-4; Nature Communications, 2019, 10, 2060; Advanced Materials, 2021, 2, 2105667; Science Advances, 2021, 7, eabg0628; Nature Communications, 2021, 12, 1670)。