肿瘤高摄取葡萄糖,并通过有氧糖酵解的方式获取能量,这种不同于正常细胞的代谢方式塑造了肿瘤独特的微环境:弱酸性、乏氧、高过氧化物和抗氧化物含量、肿瘤免疫抑制等。肿瘤微环境的这些特征削弱了肿瘤治疗,例如肿瘤微环境的乏氧及过量存在的抗氧化物严重削弱了肿瘤放疗和光动力治疗疗效;另外,肿瘤常规疗法(放疗和化疗)主要通过诱导肿瘤细胞凋亡进行治疗,而肿瘤细胞存在多种凋亡抵抗机制,使其对治疗产生耐受。因此,调控肿瘤代谢、重塑肿瘤微环境、以及改造肿瘤细胞命运(如诱导肿瘤细胞发生铁死亡)可有效增敏多种肿瘤治疗模态。
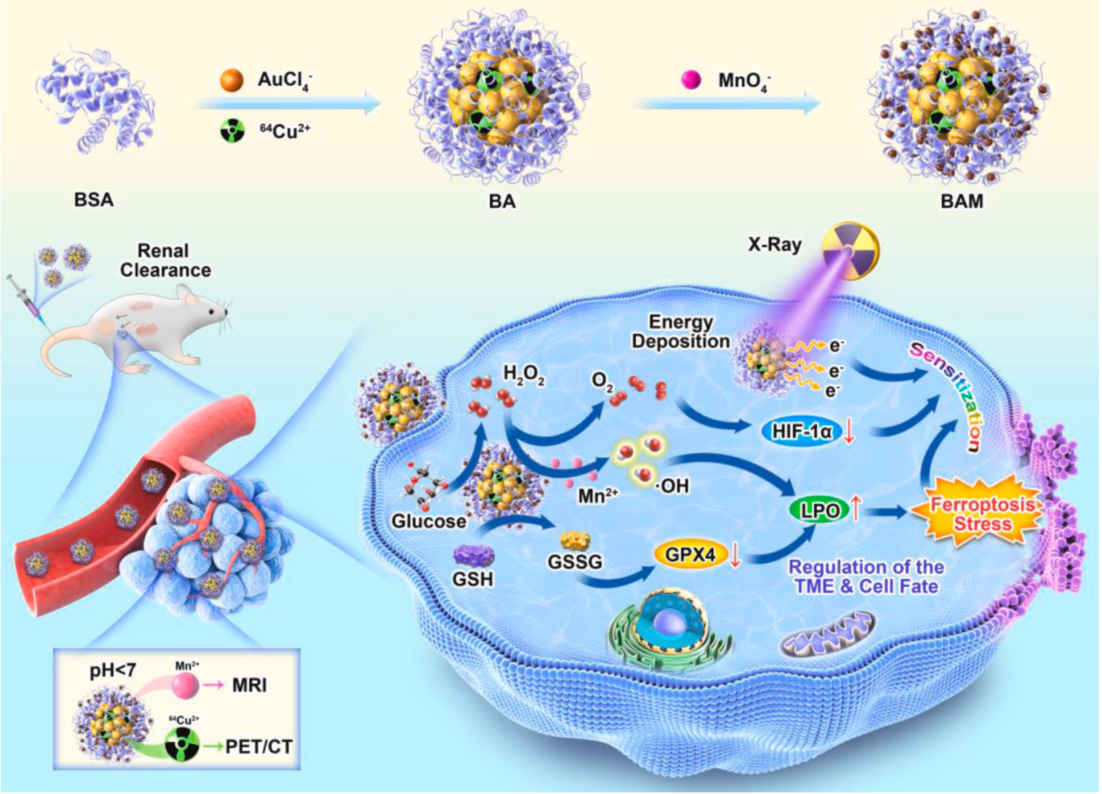
图1 “核-卫星”结构纳米酶的构建及其调控细胞命运示意图
在前期研究发现铁氧化物纳米颗粒具有高效重塑肿瘤免疫微环境(Advanced Functional Materials 2021 31(23), 2009116),调控肿瘤细胞命运向铁死亡应激发展(ACS Nano 2021 15 (4), 7179-7194)的基础上,近日我院张春富课题组启迪于生物矿化的方法,构建了超小尺度(< 5 nm)、正电子发射核素铜-64(64Cu)无配体标记的金-锰纳米复合酶,并首次发现了超小尺度锰氧化物纳米颗粒具有强葡萄糖氧化酶性质,可以高效催化分解肿瘤微环境及肿瘤细胞内过量摄取的葡萄糖,调控肿瘤糖代谢,并产生过氧化氢。同时,MnO2纳米颗粒兼具过氧化物和过氧化氢酶“多酶合一”的性质,可将产生的过氧化氢进一步分解,生成氧气和羟基自由基,在改善肿瘤乏氧的同时,杀死肿瘤细胞。而且高价态的锰离子(Mn4+)能够氧化肿瘤微环境中的还原性谷胱甘肽(GSH),打破肿瘤内在的氧化还原动态平衡,从而引起肿瘤内活性氧大量累积,导致细胞膜脂质过氧化,最终诱导肿瘤细胞发生铁死亡(图1)。
磁共振成像(MRI)和PET/CT成像显示该纳米酶能够高效靶向肿瘤,且在肿瘤区域具有高聚集、长滞留的特性,而且最终可以通过肾脏代谢清除。协同瘤内乏氧改善及高原子序数金属(金核)对放疗的增敏作用,单次低剂量X-ray辐照放疗可实现肿瘤的完全消融,彻底抑制肿瘤的生长(图2)。
本研究通过合理设计一种自级联纳米酶来调控肿瘤代谢,最终实现肿瘤细胞命运向铁死亡的重编程,为高效的铁死亡诱导及铁死亡介导的肿瘤治疗增敏提供了新的思路。

图2 自级联纳米酶体内成像及肿瘤放疗增敏效果研究
同时,二氧化锰纳米材料改善肿瘤微环境乏氧状态也可高效促进肿瘤光动力治疗效果。相关研究成果于近日相继发表在Applied Materials Today (https://doi.org/10.1016/j.apmt.2022.101558)和Acta Biomaterialia(https://doi.org/10.1016/j.actbio.2022.04.044)上。
上海交通大学生物医学工程学院博士生吴庆河和张朋利分别为论文的第一作者,张春富为论文通讯作者。
