癌细胞在肿瘤的发生和发展过程中经历代谢重编程,以满足其增加的生物能量和生物合成需求,并减轻癌细胞增殖和存活所需的氧化应激,形成了具有葡萄糖成瘾和高抗氧化水平的肿瘤微环境,给癌症治疗造成了的极大的阻碍。针对肿瘤微环境独特的代谢特征,各种新兴治疗策略,如饥饿疗法、光动力疗法和化学动力疗法,已经引起了广泛的研究并取得明显的进展。然而,由于恶性肿瘤的代谢灵活性和可塑性,使其在不利条件下获得生存优势,抵抗大多数类型的抗癌治疗。因此,调控肿瘤的这种代谢灵活性和可塑性可能是提高肿瘤传统治疗疗效的一种有效的策略。
基于此,近日我院张春富课题组联合钱昆教授团队在《Advanced Functional Materials》期刊上发表了题为“A Self-Enhancing Nanoreactor Reinforces Radioimmunotherapy by Reprogramming Nutrients and Redox Metabolisms”的文章(2023, 2212510. https://doi.org/10.1002/adfm.202212510)。该研究利用金属基纳米材料的类酶催化特性,制备了集成四种类酶活性的多金属介孔纳米颗粒(PdPtAu@TF MNPs),并将其成功应用于肿瘤代谢重编程和增强放射免疫治疗中(图1)。

图1:PdPtAu@TF纳米颗粒的合成及代谢调节示意图
通过表面活性剂导向法设计合成了Pd/Pt/Au三金属介孔纳米颗粒,并以具有pH响应性的单宁酸-铁离子(FeIIITA)金属-有机聚合物表面涂敷。酶催化性质测试结果表明,PdPtAu MNPs具有类葡萄糖氧化酶(GOx-mimic)、类过氧化氢酶(CAT-mimic)、类过氧化物酶(POD-mimic)和类谷胱甘肽过氧化物酶(GPx-mimic)“四酶合一”催化活性。由于具有高比表面积和丰富的活性位点,表现出较高的催化效率。此外,FeIIITA涂层响应酸性环境而降解,而不损害其类酶催化活性。PdPtAu@TF作为纳米反应器,有潜力通过级联催化反应重编程肿瘤营养和氧化还原代谢(图2)。

图2:PdPtAu和PdPtAu@TF纳米颗粒的类酶性质
细胞实验结果表明,PdPtAu@TF可以与癌细胞竞争葡萄糖,将其转化为过氧化氢,使细胞陷入“饥饿”状态,进而增强对“储备能源”脂质的摄取和利用。同时,在细胞内催化过氧化氢分解生成活性氧和氧气,消耗抗氧化剂谷胱甘肽,从而诱导癌细胞落入铁死亡陷阱,增敏放射治疗。此外,由于肿瘤微环中过氧化氢的提高,促进了巨噬细胞向M1表型极化,有助于克服免疫抑制,增强抗肿瘤治疗(图3)。
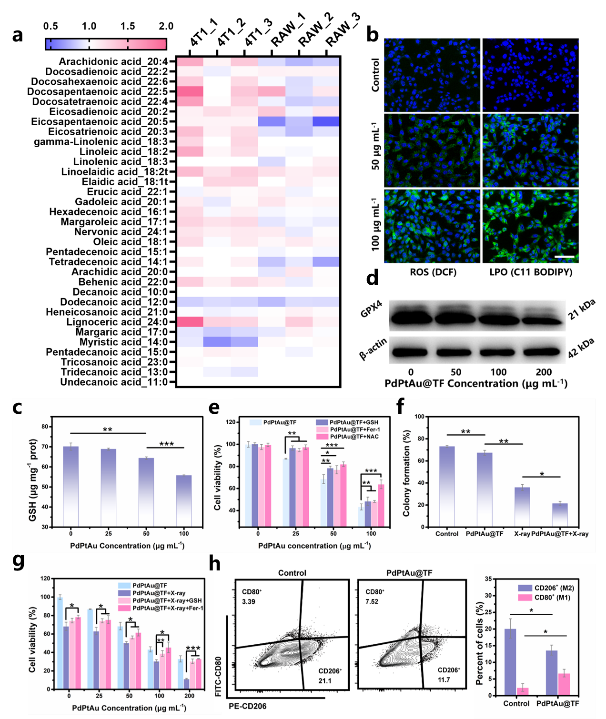
图3:PdPtAu@TF对癌细胞和巨噬细胞的代谢重编程作用
体内抗肿瘤实验表明,PdPtAu@TF可以在小鼠体内诱导肿瘤铁死亡并改善肿瘤乏氧,使癌细胞对放疗更加敏感。与对照组相比,单独PdPtAu@TF治疗或X射线治疗均能抑制肿瘤生长,但PdPtAu@TF与放疗联合的治疗显示出最突出的抗肿瘤效果(图4)。
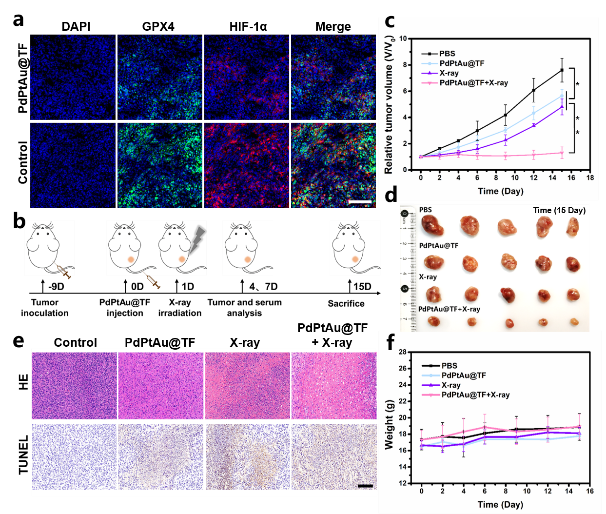
图4:PdPtAu@TF联合放疗的抗肿瘤治疗效果
同时,放疗能够有效激活小鼠免疫应答,PdPtAu@TF治疗在促进巨噬细胞向M1表型极化中发挥重要作用,而PdPtAu@TF联合放疗触发了较单一治疗更强的抗肿瘤免疫反应,能够系统地调节适应性免疫和先天免疫,将免疫“冷”肿瘤转化为“热”肿瘤,抑制转移灶的发生。
更为重要的是,平衡炎症反应介导的免疫激活和组织纤维化是克服放疗抵抗的一大挑战,PdPtAu@TF纳米酶联合放疗的治疗策略在激活免疫应答的同时,抑制了癌症相关成纤维细胞的增殖和组织纤维化的形成,并成功抑制了肿瘤转移(图5)。
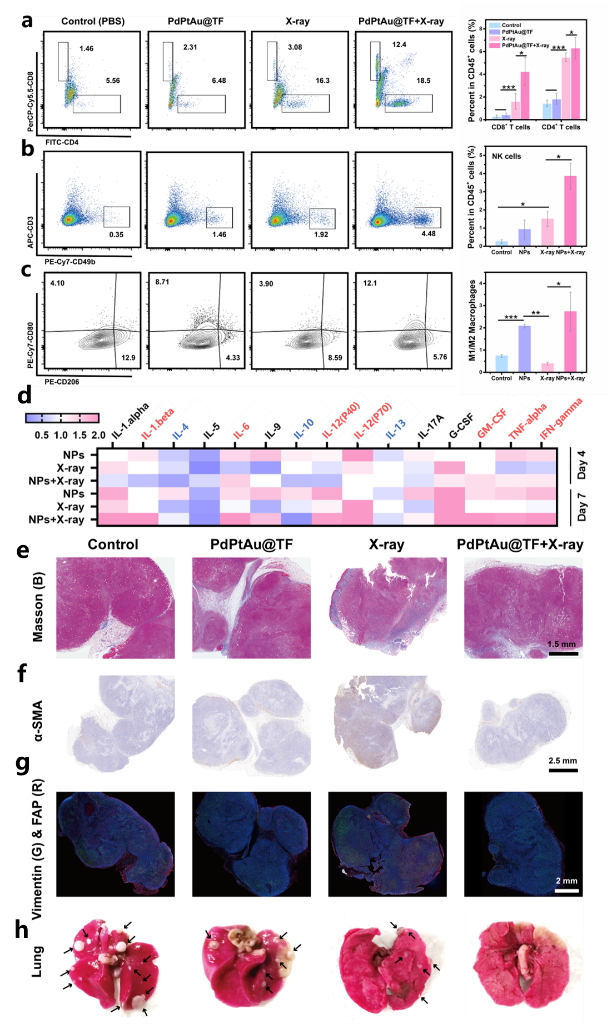
图5:肿瘤免疫应答与CAFs增殖分析
综上,本研究靶向癌症代谢的灵活性和可塑性,通过类酶催化反应重编程肿瘤营养和氧化还原代谢,显著增强了放射免疫治疗的效果,也为抗癌治疗提供了一种新的思路。
