2024年6月18日,上海交通大学生物医学工程学院李力课题组,医学院附属仁济医院薛婧课题组在 Advanced Science 上在线发表了题为“Multilevel regulation of NF-κB signaling by NSD2 suppresses Kras-driven pancreatic tumorigenesis”的研究论文。该研究揭示了 NSD2 作为肿瘤抑制因子,通过多种机制调节 NF-κB分子信号转导途径进而抑制胰腺肿瘤进程的分子机制。

胰腺导管腺癌(PDAC)是常见的消化系统恶性肿瘤之一,它发病隐匿,恶性程度高,预后差,生存期短,其 5 年生存率不足 13%,中位生存期低于 6 个月[1]。更令人担忧的是,预计胰腺癌将在 2040 年之前超越结直肠癌,仅排在肺癌之后,成为癌症相关的主要死亡原因[2]。胰腺肿瘤发生发展涉及多种基因变异,包括 KRAS、TP53、SMAD4 和 CDKN2A等。其中,90% 左右的PDAC 患者存在 KRAS 突变[5]。
NSD2 作为一种组蛋白赖氨酸甲基转移酶,主要负责催化组蛋白 3 赖氨酸 36产生二甲基化(H3K36me2)[6]。大量研究表明,多种恶性肿瘤中可见 NSD2 的异常表达,其可能机制包括 Nsd2 的转位/扩增/缺失/突变,提示 NSD2 在癌症发生发展中起着重要作用[6]。据报道,多发性骨髓瘤中的 NSD2 t (4;14) 染色体易位与 NSD2 异常高表达有关,并导致预后不良[7,8]。NSD2 在侵袭性前列腺癌中高表达,并且与前列腺癌患者的预后不良有关[9]。在其他肿瘤类型中也有类似的结果报道,例如食管癌、胃癌、肝细胞癌、肺癌和子宫体恶性肿瘤等[6]。许多研究发现 NSD2 促进细胞增殖、迁移、侵袭和上皮-间质转化 (EMT),证明其起着至关重要的促癌作用[6,10,11]。然而,NSD2 在胰腺肿瘤发生过程中的作用和机制仍不清楚。
在该研究中,首先,研究人员对临床数据库进行分析,相较于正常胰腺组织,NSD2 mRNA水平在PDAC患者肿瘤组织中降低, 提示NSD2在胰腺癌中的功能可能与以往其它癌种报道的促癌功能不一致,引起了研究人员的兴趣。接着,研究人员利用 KrasG12D 诱导的胰腺肿瘤小鼠模型,发现 NSD2在胰腺中特异过表达可抑制小鼠的炎症和 Kras G12D 诱导的腺泡导管化生。反之,NSD2在胰腺特异性缺失则促进 Kras G12D 诱导的肿瘤发生。
IκBα是NF-κB重要的核外负调控蛋白,抑制NF-κB 中的主要成员 p65 的入核。分子机制研究表明,NSD2可直接通过 H3K36me2修饰促进 IκBα的转录表达。更有意思的是,NSD2还可以与 p65 蛋白的 DNA 结合域相互作用,从而直接抑制了 NF-κB 下游转录活性。此外,利用SN50和JSH-23抑制 NF-κB 信号传导可缓解 Nsd2 缺陷PDAC小鼠的肿瘤病变表型,并使 Nsd2 缺陷型 PDAC 对吉西他滨治疗更加敏感。最后,研究人员利用临床PDAC数据库和样品,进一步证实了PDAC 患者的 NSD2 表达降低,其表达水平与核内p65水平呈负相关。
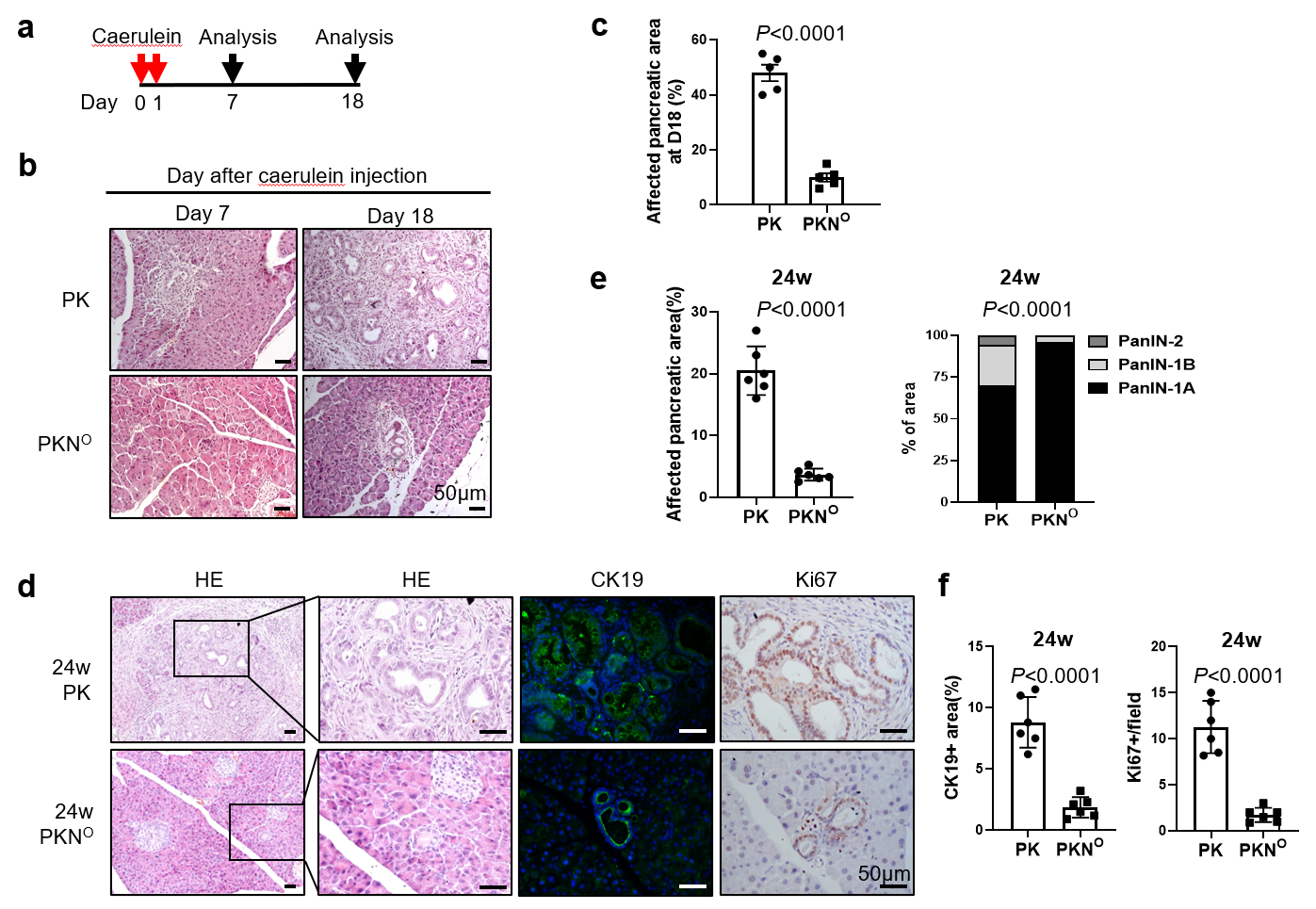
图1 NSD2 抑制炎症和 Kras G12D 诱导的胰腺肿瘤进程
由此,研究人员揭示了 NSD2 在胰腺肿瘤发生过程中对 NF-κB 分子信号传导途径的多层次调控机制。这项研究揭示了NSD2的一种新的肿瘤抑制作用机制。同时也为 NSD2 低表达/缺失的 PDAC 患者通过吉西他滨和 NF-κB抑制剂联合治疗提供了新的理论思路。
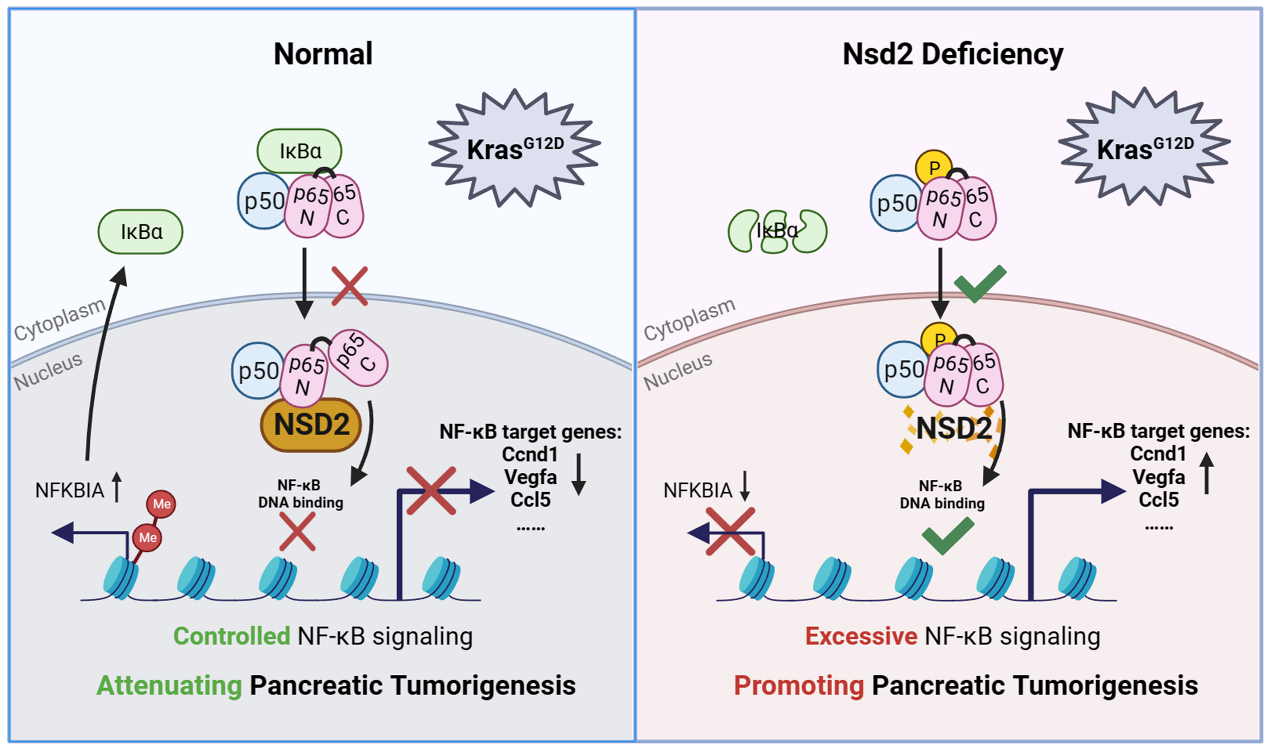
图2 NSD2 多水平调控 NF-κB 信号通路抑制胰腺肿瘤进程
上海交通大学生物医学工程学院博士研究生冯文心和医学院附属仁济医院牛宁宁副研究员为该论文的共同第一作者;李力研究员和薛婧研究员为该论文的共同通讯作者。该研究工作得到了国家重点研发计划、国家自然科学基金委以及上海市科学技术委员会的支持。
原文链接: https://onlinelibrary.wiley.com/doi/10.1002/advs.202309387
供稿单位:科研与学科办
作者:李力团队
审核:古宏晨、丁显廷
