2024年9月4日,上海交通大学生物医学工程学院夏伟梁团队和上海交通大学医学院附属胸科医院陆舜团队合作在 Science Translational Medicine 上发表了题为“PTPRT loss enhances anti-PD-1 therapy efficacy by regulation of STING pathway in non-small cell lung cancer”的研究论文。该研究首次发现并系统阐述了受体型蛋白酪氨酸磷酸酶PTPRT缺失通过调节STING通路增强免疫检查点抑制剂疗效的分子机制。

目前,免疫检查点抑制剂(immune
checkpoint inhibitor, ICI)在晚期非小细胞肺癌患者临床实践中已广泛应用,但总体临床响应率有限1,2。探索抗肿瘤免疫的机制和新靶点,并通过联合治疗提高ICI疗效是重要的研究方向。蛋白酪氨酸磷酸酶分为受体型和非受体型两类,既往研究发现SHP2,PTPN1和PTPN2等非受体型蛋白酪氨酸磷酸酶调控多种细胞因子信号通路和TCR信号通路,参与抗肿瘤免疫的调节3,4。而受体型蛋白酪氨酸磷酸酶在抗肿瘤免疫中的功能和作用机制较少报道。
在该研究中,研究团队通过对非小细胞肺癌公共数据库分析和临床样本验证,发现携带T 型受体蛋白酪氨酸磷酸酶(PTPRT)基因突变特别是磷酸酶片段突变的患者更能从ICI治疗中获益。此外,PTPRT蛋白表达阴性的患者也是ICI治疗的响应人群。由此提出肿瘤PTPRT缺失是独立于PD-L1表达的预测ICI疗效的新型生物标志物。
研究团队通过转录组蛋白组测序、分子模拟和蛋白互作等实验阐明了分子机制:PTPRT 缺失型肿瘤表现出累积的 DNA 损伤、增加的胞质 DNA和更高的肿瘤突变负荷,间接激活STING通路。同时,鉴定出PTPRT去磷酸化的新底物为STING Y240位点。肿瘤PTPRT缺失提高了STING Y240位点酪氨酸磷酸化水平,抑制了STING的泛素化降解。
研究团队进一步发现PTPRT缺失的肿瘤通过激活 STING通路分泌更多的I型干扰素和趋化因子,增加肿瘤微环境中CD8+ T细胞和NK细胞的浸润,使 “冷”肿瘤转“热”,增强了免疫检查点抑制剂在多种小鼠肿瘤模型中的治疗效果。
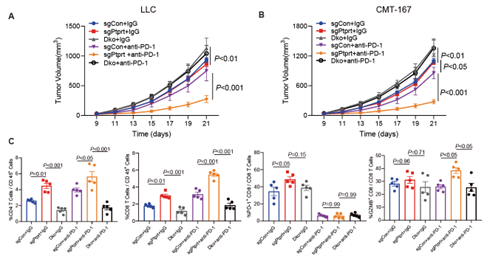
图1 肿瘤PTPRT缺失改善肿瘤免疫微环境,抑制肿瘤增长
STING通路的激活在肿瘤免疫中是一把双刃剑:STING的激活不仅促进T细胞浸润和杀伤,同时也被证明诱导免疫抑制分子如PD-L1和IDO的表达,高剂量的STING激动剂可诱导T细胞凋亡5。STING蛋白在全身多种细胞中广泛表达,STING激动剂全身给药会诱导体内大量促炎因子的分泌,甚至引发细胞因子风暴6。基于 PTPRT 对 STING 的翻译后修饰机制,PTPRT 缺失通过延缓 STING蛋白的降解不会过度激活STING,也不上调免疫抑制分子PD-L1的表达。因此,抑制PTPRT是一种有前景的策略来增强抗肿瘤免疫。
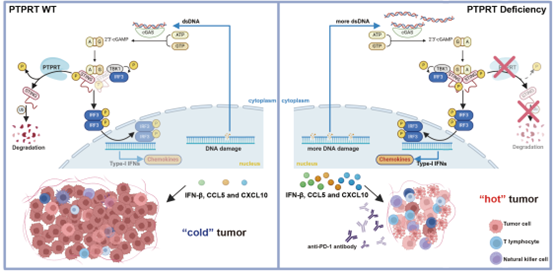
图2 研究示意图:肿瘤PTPRT缺失通过调节STING通路增强免疫检查点抑制剂疗效
上海交通大学生物医学工程学院博士研究生陈卓和上海交通大学医学院附属胸科医院主治医师纪文翔为该论文的共同第一作者,夏伟梁教授和陆舜教授为该论文的共同通讯作者。该研究获得了国家重点研发计划、国家自然科学基金、国家转化医学平台、上海市科委的支持。
夏伟梁教授研究围绕肿瘤进展、治疗抵抗的机制及新靶点发现和外泌体生物学及其应用,积极推动相关研究和专利的临床转化。该研究是夏伟梁团队和陆舜团队合作发表的第17篇论文,双方在Protein
& Cell(2023)、Oncogene(2020/2018)、Theranostics(2019)、Cancer
Letters(2018)、J Exp
Clin Cancer Res (2017)、Lung
Cancer (2013) 等期刊发表了多篇研究型论文,揭示了肿瘤外泌体和FGF/FGFR家族在调控肺癌进展、上皮间质转化和克服治疗抵抗等相关分子机制。
原文链接: https://www.science.org/doi/10.1126/scitranslmed.adl3598
参考文献
1. Morad,
G., Helmink, B. A., Sharma, P. & Wargo, J. A. Hallmarks of response,
resistance, and toxicity to immune checkpoint blockade. Cell 184,
5309–5337 (2021).
2. Ma,
X., Zhang, Y., Wang, S., Wei, H. & Yu, J. Immune checkpoint inhibitor (ICI)
combination therapy compared to monotherapy in advanced solid cancer: A
systematic review. J Cancer 12, 1318–1333 (2021).
3. Stanford,
S. M. & Bottini, N. Targeting protein phosphatases in cancer immunotherapy
and autoimmune disorders. Nat Rev Drug Discov 22, 273–294 (2023).
4. Baumgartner,
C. K. et al. The PTPN2/PTPN1 inhibitor ABBV-CLS-484 unleashes potent
anti-tumour immunity. Nature 622, 850–862 (2023).
5. Samson,
N. & Ablasser, A. The cGAS–STING pathway and cancer. Nat Cancer 3,
1452–1463 (2022).
6. Motedayen
Aval, L., Pease, J. E., Sharma, R. & Pinato, D. J. Challenges and
Opportunities in the Clinical Development of STING Agonists for Cancer
Immunotherapy. Journal of Clinical Medicine 9, 3323 (2020).