研究背景
如何实现活体组织深层光学信息的无创、快速获取,一直备受临床研究领域的关注。得益于灵敏度高、特异性强、指纹谱、谱峰窄等特点,表面增强拉曼光谱(SERS)技术得到了研究者们的青睐,多种SERS探针被开发并用于生物检测和成像。然而,和大多光学技术一样,由于生物组织中强烈的光子散射、吸收以及自发荧光干扰,传统SERS技术在获取组织深层信息方面遇到了巨大挑战。
表面增强透射拉曼光谱(SETRS)结合了SERS和透射拉曼光谱(TRS)的优势,通过将激光入射端和信号收集端分置于样品的两侧,有效地抑制了表面荧光或拉曼背景信号的影响,提高了来自组织深处的拉曼信号的信噪比。此前,叶坚教授和林俐助理教授团队已实现厚达14cm的冷冻猪肉组织中SERS探针信号的检测。此外课题组在之前的研究中曾开发了基于拉曼光谱的病灶深度预测方法,依赖于分析拉曼谱峰对强度比值(RPR)的自然对数值与病变位点深度(d)之间的线性关系,即。
然而,由于生理环境的复杂性和组织类型的多样性,SETRS在活体动物模型检测中已知的最大深度不足1.3厘米,其深层病灶检测潜力仍有待开发,在活体组织中最高能测到多深,仍是未知数。此外,该深度预测放法中的关键光学系数——光学有效衰减系数之差(Δμ)通常在冷冻样本中测得。冷冻样本易获取、保存、操作,是组织光学研究的常用样本。但是冷冻组织和新鲜组织之间的光学性质存在差异,可能影响预测结果。冷冻后检测所得和新鲜组织中测得的Δμ究竟有多大差异,冷冻后检测所得Δμ是否能满足活体复杂组织模型上的深度预测结果的准确性和稳定性,仍是未知数。因此,研究冷冻对组织样本光学性质的影响是很有必要的。
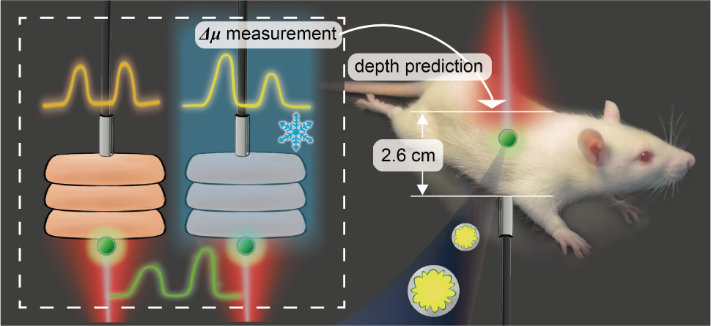
图1 SETRS系统中,使用新鲜或冷冻组织的“有效衰减系数差之差”(Δμ)预测活体大鼠病灶仿体的深度
本工作在组织结构与类型相对复杂的大鼠腹部进行了基于SETRS技术的病灶仿体深度预测,并研究了冷冻或非冷冻组织测得的光学参数对深度预测的准确性的影响(图1)。为了增加在体异质模型中的穿透深度,本工作优化了缝隙增强拉曼标签(GERTs),随后测量了大鼠不同组织在冷冻不同时间后的Δμ值,最终比较这些Δμ对深度预测准确性的影响。具体研究思路和研究结果如下文。
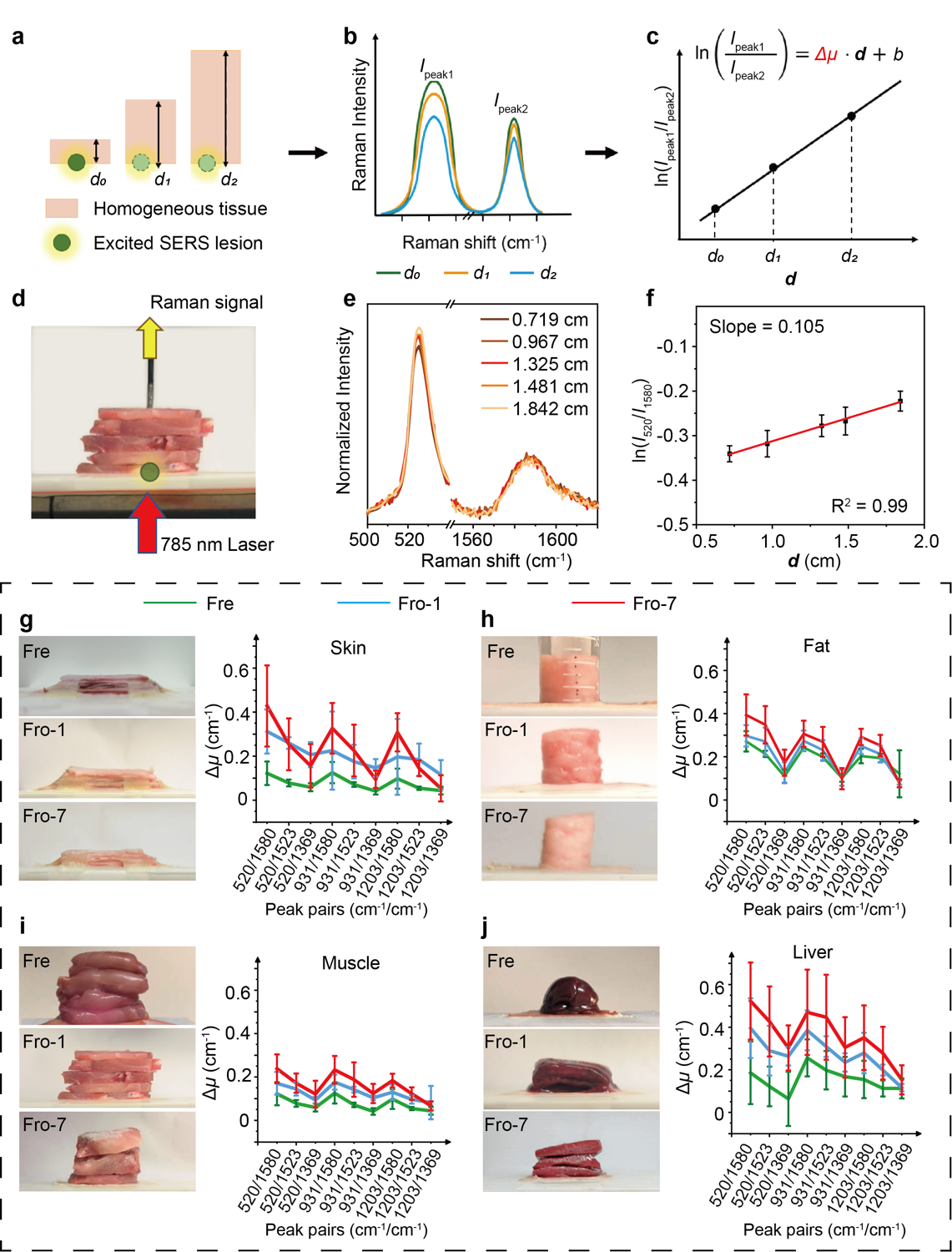
图2 基于SETRS技术的离体样本Δμ测量及冷冻前后Δμ的变化
该工作首先测定了大鼠四种组织(包括皮肤、肌肉、脂肪和肝脏)在新鲜、冷冻一天、冷冻七天状态下的Δμ值。图2中,团队研究用肌肉组织作为示例,展示了测量一种组织一个峰对的Δμ的过程。首先使用TRS系统收集拉曼光谱,785 nm宽场激光束自下而上地照射在组织块底部的SERS凝胶上,激发的拉曼光子在组织块中传播,最终被组织上表面接触的光纤式拉曼探头收集。对于同一匀质组织,团队研究人员收集了来自五个不同深度的SERS凝胶的拉曼光谱。以520和1580 cm-1的拉曼峰对为例,其自然对数值与深度呈良好的的线性关系。最终,对于每一种组织的每种冷冻状态,团队研究人员分别计算了九对拉曼峰对(520/1369、520/1523、520/1580、931/1369、931/1523、931/1580、1203/1369、1203/1523、1203/1580)的Δμ,以研究冷冻是如何影响组织Δμ,并最终影响到组织深度预测。
结果显示离体组织Δμ的变化大致遵循三个趋势:(1)在一定范围内,Δμ随着峰对之间波长差的大小而增加;(2)整体而言,大部分拉曼峰对的Δμ随着样本冷冻时间的延长而上升;(3)在所分析的四种组织中,肝脏组织在冷冻反应中表现出最显著的Δμ变化,而肌肉受到的的影响最小。
对于以上现象,团队研究人员作出如下解释:(1)波长增加,生物成分表现出更强的光吸收。因此,两个峰之间更大的拉曼位移,组织光吸收的差异更大,从而表现出更大的Δμ。(2)冷冻会破坏细胞微观结构,致使血红蛋白转变为含氧状态,吸收更多长波长的光,导致冷冻后Δμ整体呈上升趋势。(3)肝脏含有大量血液,其Δμ更容易受到冷冻的影响。
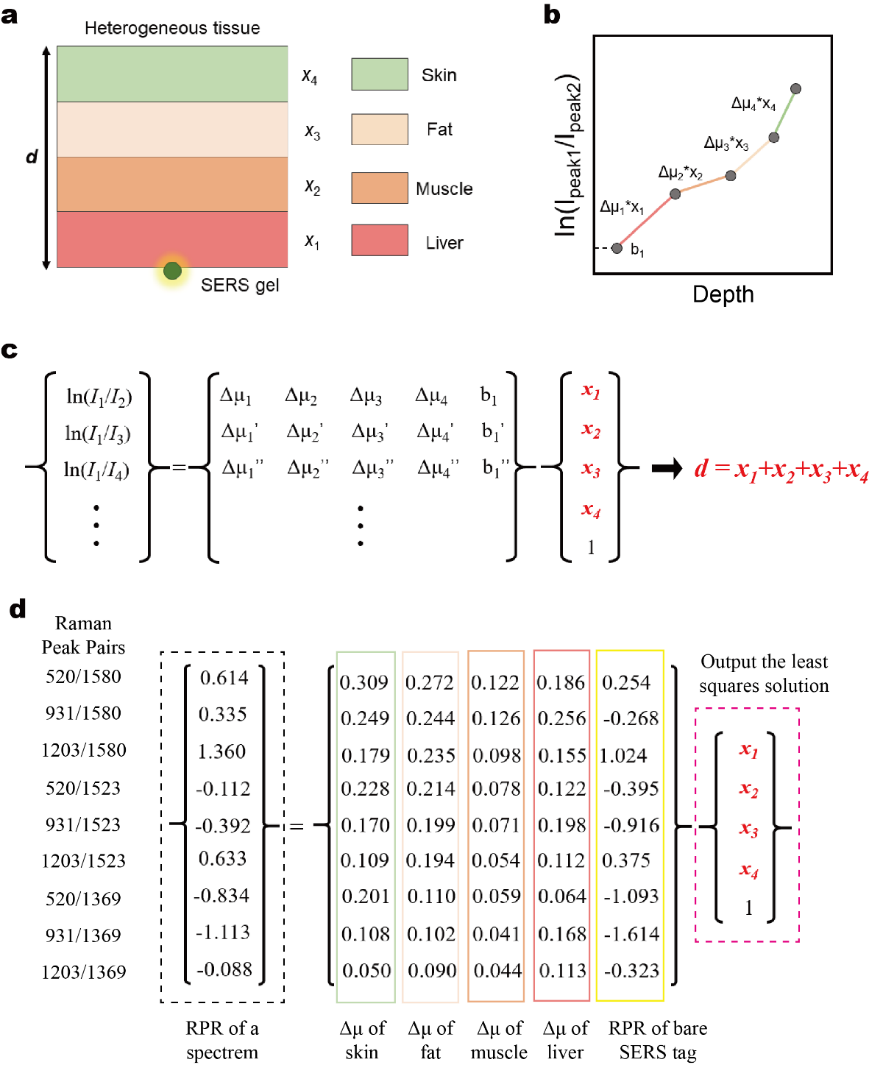
图3 活体大鼠肝脏病灶仿体深度预测模型示意图
接下来,团队研究人员参考了课题组已发表的深度预测理论模型(Small Method, 2023, 7, e2201334)。在进行大鼠肝腹部深度预测时,拉曼光子会穿过四种不同组织(肌肉、脂肪、皮肤和肝脏),不同波长的拉曼光子构成的每个拉曼峰对有一个Δμ组(有来自同一条件测得的四种组织对应的四个Δμ值构成)。这四种组织的Δμ、拉曼光子在各个组织中走过的距离以及拉曼光子强度比值的对数值存在如图3的关系。因此,为了求解拉曼光子穿透的总组织深度d(即SERS凝胶深度),需要构成如图所示的超定方程,通过最小二乘法求解出x1, x2, x3, 和x4,并最终计算出预测深度d。
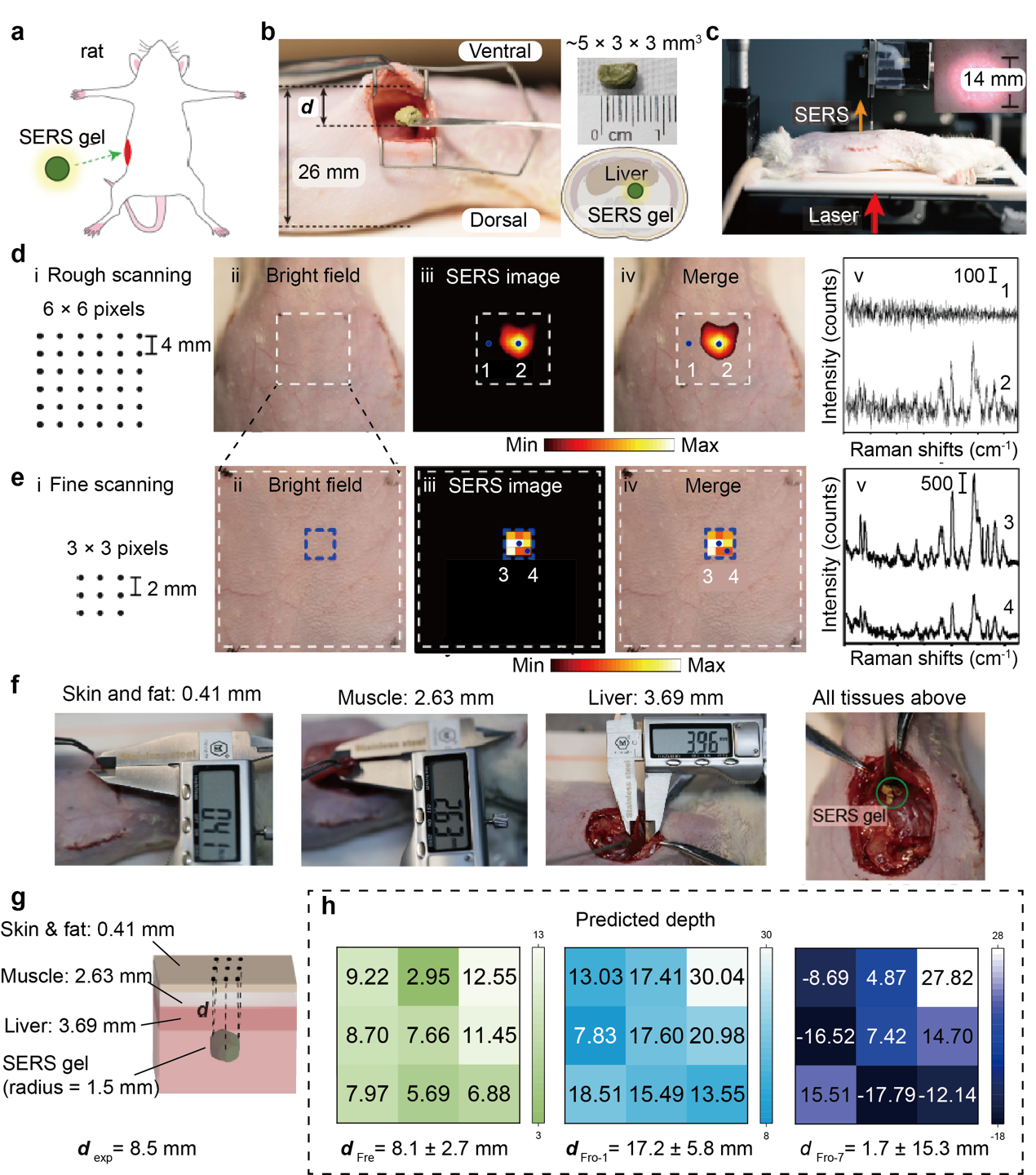
图4 SETRS系统中对活体大鼠体内SERS病灶仿体进行无创检测,并使用新鲜或冷冻组织的“有效衰减系数差之差”(Δμ)预测模拟病灶的深度
最后,利用上述深度预测模型,团队研究人员将测得的Δμ值用于活体大鼠模型中SERS病灶仿体的深度预测。如图4,首先通过手术将SERS病灶仿体植入活体大鼠的腹部。然后,通过两步法扫描对病灶仿体进行精准定位,并收集病灶仿体投影点及其周围八个点的光谱信息。扫描过程中,使用光斑的激光功率密度约0.22 W/cm2,低于临床MPE阈值(0.3 W/cm2),保证了测试过程的光安全性。测试结束后,对大鼠进行安乐死,并通过解剖确定病灶仿体的深度。
在构建深度预测超定方程时,每个Δμ组分别从新鲜样本、一天冷冻样本和七天冷冻样本中获得。绿色图表示使用新鲜组织测量的Δμ进行预测,预测值为8.1 ± 2.7 mm,与实际深度非常接近,偏差小于5%。相比之下,使用冷冻一天或七天组织的Δμ的预测深度分别为17.2 ± 5.8和1.7 ± 15.3 mm(浅蓝色和深蓝色图)。这些预测与实际深度大相径庭,深度预测相对标准偏差(RSD)超过50%。实验证明,冷冻组织的Δμ值对深度预测结果影响较大,不适合用于预测复杂活体动物的深度。因此,冷冻会改变组织的光学特性,进而大幅度影响Δμ在组织深度预测中的适用性。
总体而言,本工作采用高亮度的缝隙增强拉曼探针,最终实现了在活体复杂生物模型中整体光学穿透深度达2.6 cm,目标病灶仿体深度超过0.8 cm的准确深度预测。研究还发现经过冷冻的样本,其Δμ值会明显改变,进而影响到深度预测的准确性。这项工作推动了 SERS 领域的发展,有助于在高度复杂的活体模型中进行深度预测研究,并填补了拉曼领域在光学系数研究方面的空白。此外,本工作还研究了冷冻对样品和光学深度预测技术的影响,从而拓展了 SETER 系统在体内生物医学应用方面的潜力。总的来说,用于深度预测的 SETER 在临床应用方面很有前景。
上海交通大学生物医学工程学院硕士生周羽彤为本文的第一作者。上海交通大学生物医学工程学院林俐助理教授和叶坚教授为本文的共同通讯作者。该研究工作得到了国家自然科学基金委、上海妇科肿瘤重点实验室、上海交通大学医工交叉合作基金的支持。这项工作也获得了由上海市教育委员会 “晨光计划”的支持。
叶坚教授课题组主页:http://www.yelab.sjtu.edu.cn