在再生医学与组织工程的前沿领域,科学家们一直在寻找能够模拟人体组织环境、支持细胞生长并最终构建健康组织的理想材料。明胶水凝胶(以甲基丙烯酸化明胶,即GelMA为代表)因其优异的生物相容性、可降解性以及天然促进细胞黏附的特性而备受青睐。然而,随着应用需求不断提升,传统GelMA在力学性能上的“短板”愈发凸显:尽管在实验室条件下“养细胞”得心应手,但在高负载压力或对结构精度要求严苛的应用场景(如复杂组织构建和高精度3D生物打印)中却显得力不从心,如同体质羸弱的选手难以胜任“重量级”赛事。这一限制不仅降低了明胶水凝胶在构建复杂生物结构时的稳定性和可靠性,也阻碍了其从实验室向临床与产业应用的推进。
近日,上海交通大学生物医学工程学院林秋宁研究员、鲍丙坤助理教授团队与附属第一人民医院廖赟教授团队合作,在前期发展的“光触发瞬态自由基-稳定自由基偶联(PTPC)”反应机制的基础上(Nat. Mater. 2023, 22, 1253, doi.org/10.1038/s41563-023-01648-4),通过深入的结构设计与优化,不断突破明胶水凝胶的力学性能,开展了一系列研究工作:首先,团队推动明胶分子自发形成相分离结构,并通过建立相间紧密连接,改造了原本“柔弱”的GelMA水凝胶,获得了升级版的h-GelMA水凝胶(Adv. Mater. 2025, 37, 2416432, doi.org/10.1002/adma.202416432);随后,通过引入少量可降解的透明质酸,进一步优化相分离微观结构,使明胶水凝胶的强度提升至10 MPa(Adv. Mater. 2025, 2501051, doi.org/10.1002/adma.202501051)。
核心突破:相分离微观结构铸就强韧特性
不同于依靠自由基聚合形成单一网络结构的传统GelMA水凝胶,研究团队采用PTPC反应策略,让明胶分子在光照条件下迅速产生分散的明胶硬质微区。这些硬质微区通过化学键合牢牢嵌入周围的明胶基质中,从而构筑出相分离、且相间紧密连接的内在结构。这种结构设计使得h-GelMA水凝胶的拉伸强度和韧性较常规GelMA水凝胶提高了2-3倍以上。值得一提的是,与目前主流方法(如构建复合材料或进行盐析处理)不同,该策略无需引入任何其他成分,使得水凝胶可100%保留明胶分子的天然特性,既强化了性能又不损害生物学优势。
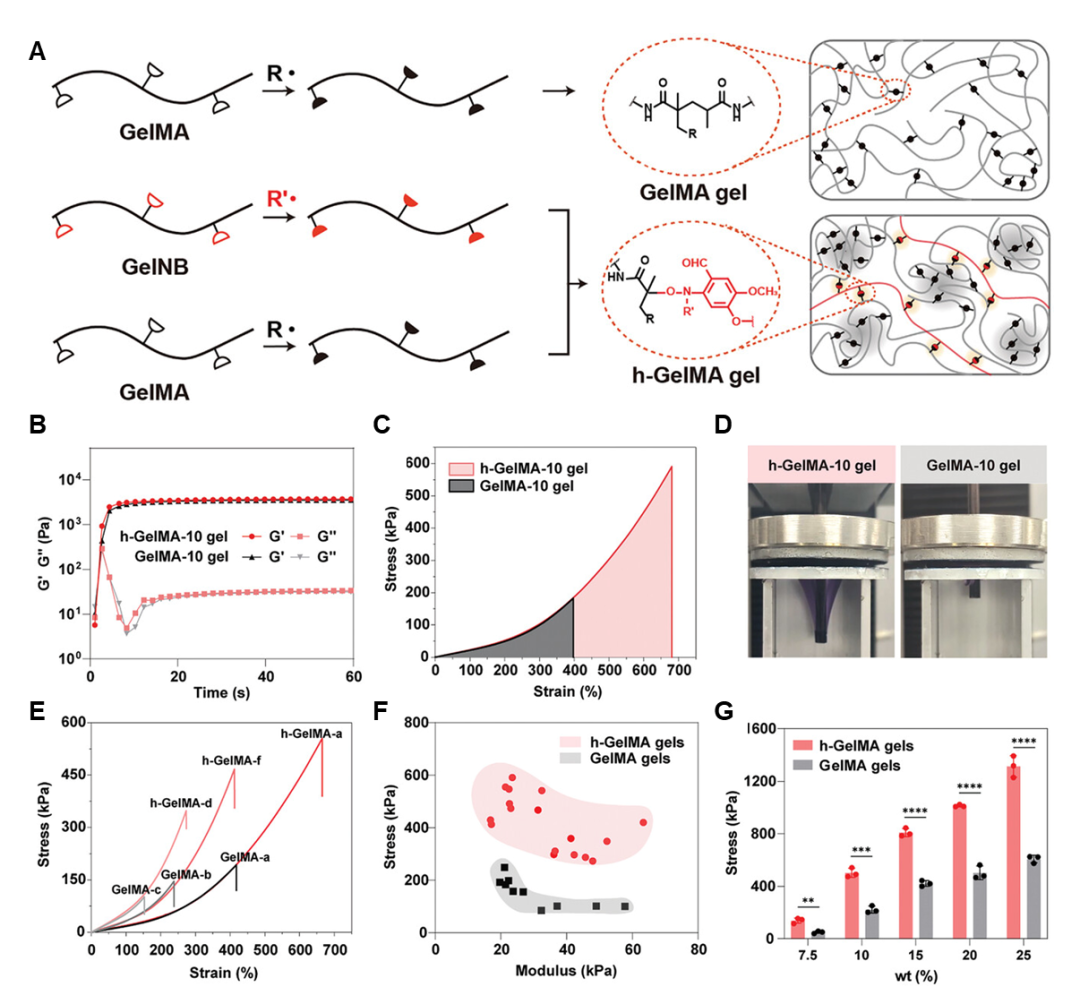
图1 h-GelMA水凝胶和GelMA水凝胶在微观结构和力学性能上的对比
保持明胶固有的生物学特性:降解性、细胞黏附、生物安全兼得
在实现力学性能大幅提升的同时,h-GelMA水凝胶依然保留了明胶材料核心的生物学优势。研究表明,h-GelMA水凝胶在降解性方面与传统GelMA水凝胶无显著差异。在胶原酶溶液环境下,h-GelMA水凝胶能够完全降解,且降解速度和特性与传统GelMA水凝胶保持一致。此外,无论是将细胞包埋于水凝胶内部,还是让细胞黏附于其表面,h-GelMA水凝胶均能提供理想的生存环境,保障细胞的高存活率与正常生长行为。在将h-GelMA水凝胶植入大鼠皮下后,其生物安全性与组织相容性表现与传统GelMA水凝胶一致。这意味着升级后的水凝胶依旧是一个适合细胞生存与组织再生的理想载体。
加速3D生物打印与再生医学进程
不同于依靠自由基聚合形成单一网络结构的传统GelMA水凝胶,研究团队采用PTPC反应策略,让明胶分子在光照条件下迅速产生分散的明胶硬质微区。这些硬质微区通过化学键合牢牢嵌入周围的明胶基质中,从而构筑出相分离、且相间紧密连接的内在结构。这种结构设计使得h-GelMA水凝胶的拉伸强度和韧性较常规GelMA水凝胶提高了2-3倍以上。值得一提的是,与目前主流方法(如构建复合材料或进行盐析处理)不同,该策略无需引入任何其他成分,使得水凝胶可100%保留明胶分子的天然特性,既强化了性能又不损害生物学优势。
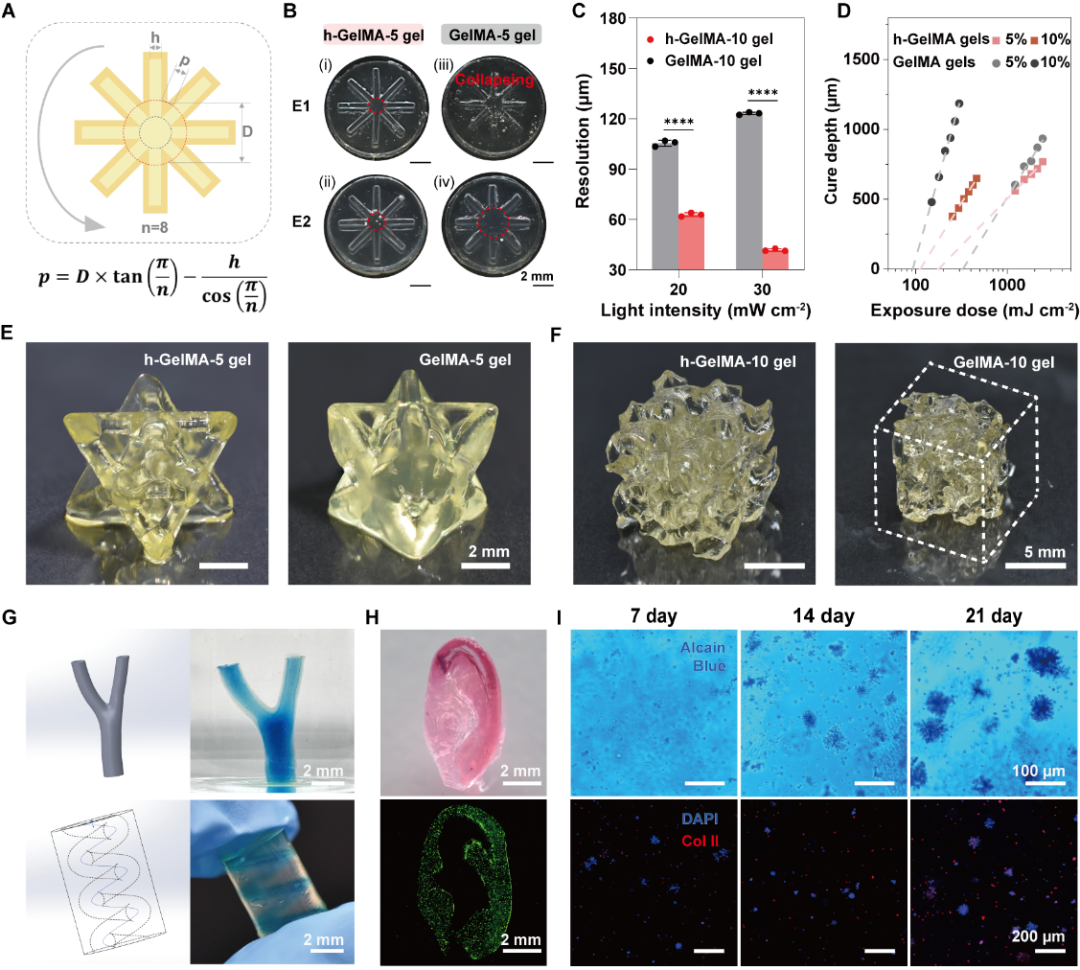
图2 h-GelMA水凝胶结合DLP打印技术在组织器官构建中的应用前景
结构优化:明胶水凝胶力学性能再突破
在此基础上,研究团队选用透明质酸作为分相结构中的硬相,形成类似纳米复合材料的微观结构,并借助纳米增强效应提升明胶水凝胶的力学性能。这一选择基于透明质酸出色的生物相容性和完全可生物降解性。团队将邻硝基苄醇改性的明胶(GelNB)、少量甲基丙烯酸化透明质酸和光引发剂混合制备成前体溶液,在395 nm光照射下制备明胶水凝胶(GelNB凝胶)。通过原子力显微镜和电子显微镜等表征手段,证实了透明质酸聚合后形成的高密度颗粒。当其含量为3.6%时,GelNB水凝胶的拉伸强度达到10 MPa,展现了惊人的力学性能。
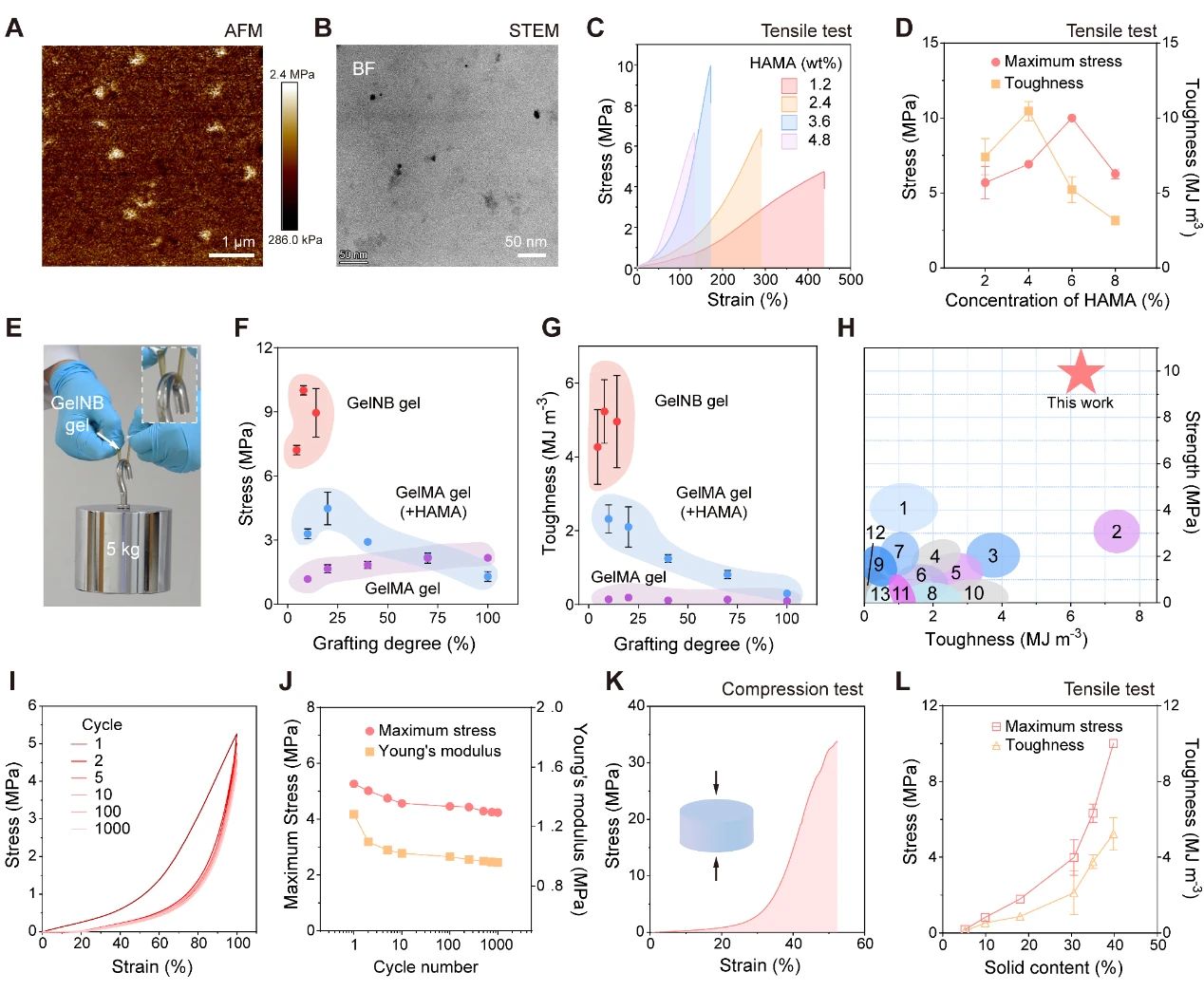
图3 GelNB明胶水凝胶的微观结构和力学性能
支架构筑:明胶水凝胶也能“撑”起来
GelNB水凝胶的出色力学性能表现与快速制备,可以与DLP 3D打印等先进制造技术高度适配,构建定制化结构的支撑性支架。该水凝胶支架具有优异的细胞粘附能力,支持细胞迁移,促进组织修复。同时,其在发挥功能后可完全降解,从而为新生组织腾出生长空间。此外,其出色的组织顺应性能够有效规避对组织的力学刺激和机械损伤。典型地,结合药物负载和缓释,GelNB水凝胶能够促进骨再生,显著缩短骨修复所需的时间,在支撑性应用场景下展现了广阔应用情景。
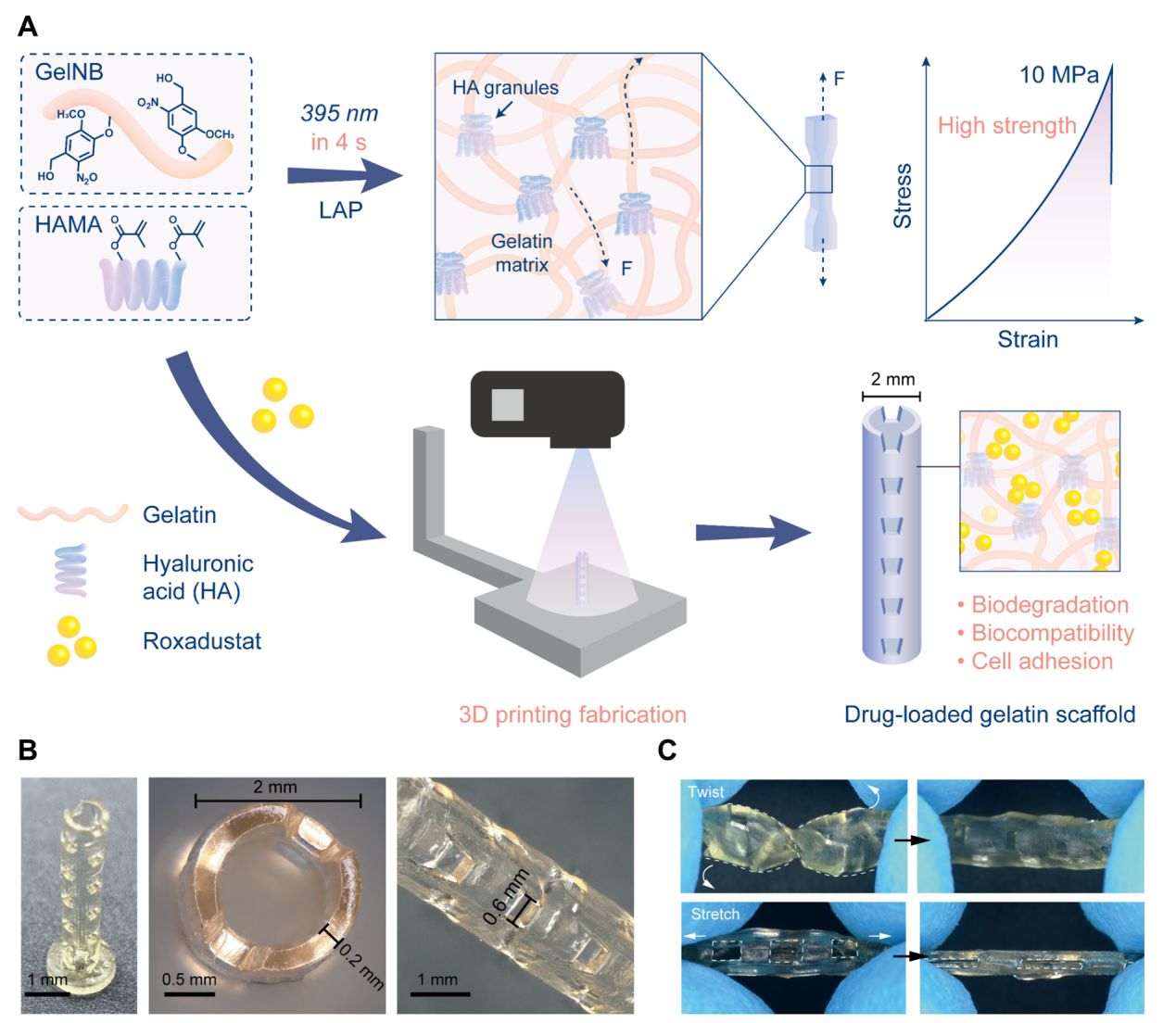
图4 GelNB明胶水凝胶构建定制化结构的支撑性支架
课题组介绍
上海交通大学生物医学工程学院林秋宁(https://bme.sjtu.edu.cn/Web/FacultyDetail/634)长期致力于生物医用材料的基础及应用研究,提出了基于光化学偶联反应构建水凝胶的新方法,以及近红外光控制药物释放的新策略。鲍丙坤(https://bme.sjtu.edu.cn/Web/FacultyDetail/969)主要研究水凝胶材料的设计与3D打印制备,探索其在可穿戴设备、人工组织与器官等前沿生物医学领域的应用。